(浙江大学医学院附属第一医院肝胆胰介入诊治中心 浙江杭州 310003)
【摘要】目的:评价超声引导下激光消融术在高危部位小肝癌中的临床应用价值。方法:将2016年1月—2017年4月在我院行激光消融并得到有效随访资料的肝癌患者56例65个病灶分为高危部位组和非高危组,通过分析两组的消融前后CT和(或)MRI,比较两组病灶的消融效果和并发症发生率。结果:高危组和非高危组病灶的完全消融率无统计学差异(P>0.05,分别为86.3%、91.2%),并发症发生率分别为9.0%、5.8%(P>0.05)。
结论:超声引导下激光消融疗效确切、安全性高,尤其适合高危部位小病灶的精准消融。
手术切除是目前肝癌治疗手段的常规选择,但由于受到肝功能、肿瘤进展程度及全身状况等因素的影响,仅有5%~20%的患者适合手术切除。接受局部治疗是基于大部分肝癌患者的最佳选择。其中大量研究证实以RFA和MWA是一种微创且安全有效的治疗方法,但两者仍具有一定的局限性。有文献报道约23.4~34.7% 肝癌患者病灶位于高危部位,针对这些高危部位的肝癌,RFA和MWA极易导致严重并发症或消融不完全。近年来,激光消融治疗肝癌被认为是一种有前途的治疗方法。因此,本研究旨在对激光介入治疗后高危部位小肝癌的疗效作初步分析,并与非高危部位的肝癌的疗效进行比较,以探讨激光消融术在高危部位小肝癌治疗中的有效性及安全性。
1.材料与方法
1.1 研究对象
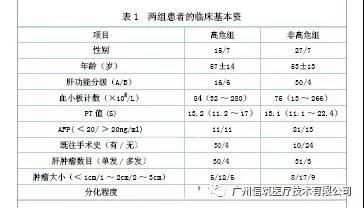
2016年1月—2017年4月间在我院实施了超声引导下激光消融并得到有效随访资料的肝癌患者56例65个病灶,其中男34例,女22例,年龄30~81岁,中位年龄55岁。高危部位肝癌定义为:(1)距第一肝门区一级或二级血管、胆管<5mm;(2)距肝外器官(如胃肠道)<5mm;(3)距胆囊壁<5mm;(4)距肝脏表面包膜<1cm;(5)距下腔静脉或者肝静脉主干<5mm。余肝内病灶定义为非高危组。两组患者的一般资料(见表1)。非高危组患者34例共计41个病灶;高危组患者22例共计24个病灶。高危组病灶中靠近尾状叶病灶有5个,第一肝门的有5个,胆囊的有4个,心脏的有5个,胃肠道的有2个,肝包膜的有3个。56病例65个病灶均经病理证实,包括原发性肝癌40例,转移性肝癌16例,其中肺癌肝转移6例,肠癌肝转移10例。
1.2 仪器
选用Mylab-Twice超声诊断仪,探头为CA541,频率为2.0~4.0MHz。激光消融仪器为意大利超声激光集成系统Ech01aser x4,包括脚踏开关、21G PTC穿刺针、4条无菌光纤(黄、红、蓝、绿4色,长15cm)、光纤连接器及主机。
1.3 治疗方法
1.3.1 术前准备 术前评估患者实验室检查及影像学检查,患者有无消化道出血、高血压、心脏病、及腹部手术史等,血常规、尿常规、大便常规,凝血功能、肝肾功能电解质以及肿瘤标志物、术前四项(乙肝、丙肝、梅毒、HIV)是否正常。CT/MRI资料,明确肝内病灶数目、大小、位置、形态、内部回声、周边毗邻及血供、转移情况。
1.3.2 术中操作 选择合适体位,超声择点定位,常规消毒,2%利多卡因局麻后,超声引导下将21G套管针穿刺进入肝脏肿瘤内部,拔出针芯,将光纤放入套管针鞘,见光纤头端的高回声在针尖前端露出,到达预定位置后固定光纤。设定激光消融功率为5w,作用能量到1200J,确定各项治疗参数无误后启动激光消融。消融过程中可用超声实时观察肝脏肿瘤回声的改变。当消融范围(高回声)覆盖病灶外0.5~1.0cm时停止激光消融。
1.3.3 随访和疗效评估 治疗后1个月复查肝脏CT和(或)MRI、超声造影及AFP。1年内,每隔3个月复查复查肝脏CT和(或)MRI、超声及AFP。“肿瘤完全消融”为消融术后病灶边缘或内部无增强效应;“部分消融”为病灶边缘或内部存在部分增强;“局部复发”为术后首次复查CT/MRI提示肿瘤完全坏死和(或)AFP正常,之后消融灶出现边缘或内部增强和(或)AFP出现先降后升。
2.结果
2.1 消融病灶分析
所有病灶消融功率为5w,能量范围1200J~7200J,作用时间5~24min。激光消融术后疗效评估以增强CT或增强MRI检查为金标准。影像综合评估提示56个病例中术后完全消融共计50例,完全消融率为89.2%(50/56);34例非高危患者中完全消融病例31例,完全消融率为91.2%(31/34);22例高危患者中完全消融病例19例,完全消融率为86.3%(19/22)。

2.2 副作用及并发症情况
4例患者发生轻微并发症,其中高危组2例(胸腔积液2例),非高危组例2例(发热1例,少量腹水1例)。并发症发生率在高危组为9.0%(2/22),在非高危组为5.8%(2/34),两组之间的差异无统计学意义。
3.讨论
激光消融为近年来研发较快的一种热消融方法,具有操作简便、微创、疗效良好、易为患者接受等优点。本研究应用激光消融治疗65个肝癌病灶并评估其疗效,发现高危组和非高危组的完全消融率分别为86.3%、91.2%,无明显统计学差异,提示激光消融在两组具有同样的效果。
可能的原因有:
(1)现有的激光消融光纤21G,相对与射频微波消融针直径(17G~16G)较细,损伤重要组织结构的风险大大降低;
(2)激光瞬时能量大,大血管周围热沉效应影响小,对病灶的消融更彻底;
(3)在预设位置内,激光消融方式为精准前向消融,降低大血管等重要组织结构损伤。既往研究表明[5],膈顶部肝癌RFA后易致心律失常、气胸、胸膜渗出、膈肌穿孔等较严重并发症。但本研究应用激光消融治疗膈顶部肝癌,发现单根裸尖激光纤维单次消融范围16~18mm(Length)×8~10mm(Thickness),尤其适合位置复杂的肝癌(靠近膈顶部、肝包膜、近大血管或胃肠道等)。同时离体和活体实验数据报道[9],单根激光光纤在5w功率作用1000~1200J时消融范围长径一般在1.5cm~2.0cm,短径在仅1.5cm左右,适合高危部位小病灶的精准消融。
对比RFA、MWA,激光消融术后并发症发生率略减少[6]。轻微并发症包括轻微腹痛、低热、胸腔积液和轻度肝功能损伤等[7]。本研究中所有患者均采用了超声引导下经皮激光消融,均未发生严重并发症,其中高危组2例(胸腔积液2例)与非高危组例2例(发热1例,少量腹水1例)的并发症发生率无统计学意义。结果提示激光消融对于不同位置的肝癌,其并发症的发生可能与病灶的位置无明显相关性。可能的原因是相比射频,微波针,单根激光针更细、消融范围更精确,术后并发症显著降低。本研究暂未对影响激光消融后复发率的因素单独探讨,待进一步研究明确。
通过应用激光消融在本组高危部位肝癌患者中的成功开展,提示超声引导下激光消融对于不同部位及大小肝癌的治疗中是安全有效的,本研究的局限性有:样本量较小,随访期较短,激光消融方式及疗效有待进一步积累和总结。
【参考文献】
[1] ParkinDM,BrayF,FerlayJ,et al.Estimating the world cancer.[2] Hu RH,LeePH,ChangYC,et al.Prognostic factors for hepatocellular carcinoma<or=3 cm indiameter.Hepatogastroenterology,2003,50:2043-2048.
[3] LivraghiT,MeloniF,Di Stasi M,et al.Sustained complete respinse and complications rates after radiofrequency ablation of very early hepatocellular carcinoma in cirrhosis:is resection still the tratment of choice?.Hepatology,2008,47:82-89.
[4] KomorizomoY,OketaniM,SakoK,et al.Risk factors for local recurrence of small hepatocellular carcinoma tumors after a single session,singleapplication of percutaneous radiofrequency ablation. Cancer,2003,97(5):1253-62.
[5] Puls R,LangnerS,RosenbergC,et al.Laser ablation of liver metastases from colorectal cancer with Mr Thermometry:5-year survival.J VascInterv Radil,2009,27(16):2615-21.
[6] Yan K,ChenMH,YangW,etal.Radiofrequency ablation of hepatocellular carcinoma:long-term outcome and prognostic factors.EurJ Radiol,2008,67:336-347.
[7] BownSG.Photothermpy of tuors.World J Surg,1983,7:700-709.
